ELEKTRONO ENERGIJOS IR IMPULSO MOMENTO KVANTAVIMO YPATUMAI
Detali informacija
Ištrauka
ELEKTRONO ENERGIJOS IR IMPULSO MOMENTO KVANTAVIMO YPATUMAI
Referatas
Turinys
Įvadas 3
1. Vandenilio atomo Boro teorija 4
2. Vandeniliškieji jonai ir jų spektrų kilmė Boro teorijoje 4
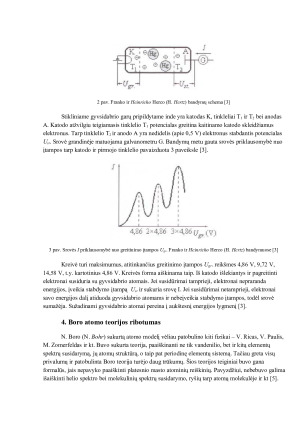
3. Eksperimentinis Boro postulatų tikrinimas (Franko ir Herco bandymas) 6
4. Boro atomo teorijos ribotumas 7
5. Boro teorijos laimėjimai ir sunkumai 7
6. Boro teorijos panaudojimas 8
Išvados 10
Literatūra 11
Įvadas
Šviesa yra elektromagnetinis spinduliavimas, kurio bangos ilgis yra matomas akiai arba,
bendresne prasme, elektromagnetinis spinduliavimas nuo infraraudonųjų iki ultravioletinių
spindulių. Šviesa turi dvilypę prigimtį, tai: elektromagnetinės bangos ir šviesos dalelių – fotonų – srautas [8].
M. Plankas teigė, jog šviesos šaltinis šviesą spinduliuoja ne ištisai, o tam tikromis
porcijomis – kvantais. Į kvantą galima žiūrėti kaip į savotišką šviesos dalelę – fotoną. Šviesą gali
spinduliuoti ir aplink atomo branduolį skriejantys elektronai. Arčiau atomo branduolio esančiose
orbitose skriejantys elektronai turi mažiau energijos nei tolimesnėse orbitose skriejantys elektronai.
Jei elektronas gauna kiekį energijos, jis turi peršokti į toliau branduolio esančią orbitą (tokie
elektronai vadinami sužadintaisiais), tačiau judėdamas jis praranda energiją ir natūraliai grįžta į savo vietą.
Energija, kurią išskiria elektronas, lygi skirtumui tarp energijos lygių. Šį kvantą energijos
elektronas gali išspinduliuoti fotono forma. Elektromagnetines bangas, kurių ilgiai yra nuo 700 nm
(raudona spalva) iki 400 nm (violetinė spalva), žmogaus akis fiksuoja ir supranta kaip šviesą [8].
Matoma šviesa yra spektro dalis tarp 380 nanometrų (sutrumpintai nm) ir 750 nm (ore) bangų ilgio.
1945 m. Austrijos fizikos instituto direktorius prof. Feliksas Ehrenhaftas atliko bandymus su
vakuuminiame inde esančiomis mažomis grafito dalelėmis. Jas apšvietė stipria šviesa. Dalelės
pakilo viršun, sukosi apie savo ašį, bei judėjo elipse. Jis priėjo prie išvados, kad „šviesa turi
sukamąją jėgą“ [10].
Kvantinė teorija teigia, kad elektronai atome esti išsidėstę tam tikrose orbitose (lygmenyse).
Elektrono energija atome priklauso nuo to, kuriame lygmenyje jis yra. Kiekvienas elektronas turi
savo pagrindinį lygmenį, kuriame jis gali būti neribotą laiką, ir daugybę sužadintų lygmenų, į
kuriuos jis gali patekti tik gavęs iš šalies papildomos energijos. Juose elektronas gali būti tik ribotą
laiką. Jei atomas turi daug elektronų, tai kiekvienas elektronas turi savo pagrindinius ir sužadintus
lygmenis [9].
Paulio (V. Pauli) draudimo principas teigia, kad viename lygmenyje gali būti ne daugiau
dviejų elektronų. Jei tame pačiame lygmenyje esti du elektronai, tai jų sukiniai turi būti priešingi.
Kitaip sakant, vienodą energiją atome gali turėti ne daugiau dviejų elektronų [9].
1. Vandenilio atomo Boro teorija
1897 m. Tomsonas (W. Thomson) atrado elektroną ir 1903 m. sukūrė pirmąjį atomo modelį:
atomas yra mažas rutuliukas, kuriuo teigiamasis krūvis tolygiai pasiskirstęs visame tūryje. Atomo
viduje yra elektronų, kurių bendro neigiamojo krūvio modulis lygus atomo teigiamajam krūviui.
Dėl to atomas yra elektriškai neutralus. Deja, Rezerfordas (E. Rutherford) 1910-1911 m.
eksperimentiškai įrodė, kad toks atomo modelis klaidingas. Tirdamas α dalelių (He2+), pereinančių
per labai ploną metalo plėvelę, sklaidą, jis nustatė, jog dauguma jų pereina nekeisdamos sklidimo
krypties, bet pasitaiko ir tokių, kurios nukrypsta kampu, artimu π. Šioms nuokrypoms paaiškinti
Rezerfordo (E. Rutherford) pasiūlė naują branduolinį atomo modelį: beveik visa atomo masė ir visas teigiamasis krūvis sukoncentruotas apie 10 -15m skersmens atomo branduolyje. Apie branduolį maždaug 10
-10 m atstumu skrieja elektronai [6].
Mūsų mokslo darbų bazėje yra daugybė įvairių mokslo darbų, todėl tikrai atrasi sau tinkamą!